2017年11月04日 来源:药渡
中国人肾癌患病人数在46万以上;
舒尼替尼适应症拓展卓有成效;
肾癌靶向药物难觅本土创新药踪影,贝达新药处于三期临床。
在第二十届全国临床肿瘤学大会暨 2017 年 CSCO 学术年会上,CSCO 官方发布了 2017.V1 版肾癌诊疗指南。中国肾癌诊疗指南从最初的 2013 版,到 2015 版,直至如今的 2017 版,越来越注重以中国人群数据为基础。
流行病学和病因学
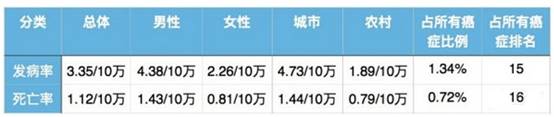
最新数据统计分析显示,我国肾癌发病率近年来呈快速递增趋势,35 岁以下的患者少见,而 35 岁以上的发病率快速升高,至 75~80 岁人群达到高峰(14.7/10 万)。发病率及死亡率情况是男:女 = 2:1。国内患者人数在46万人以上。其他相关数据见下表:
CSCO推荐的一线治疗方案
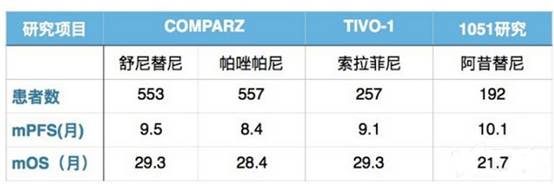
新版指南对中低危患者一线治疗基本策略的推荐主要是基于 TIVO-1、COMPARZ、1051 三项研究果,对比中位无进展生存期(mPFS)及中位总生存期(mOS)数据,见下表:
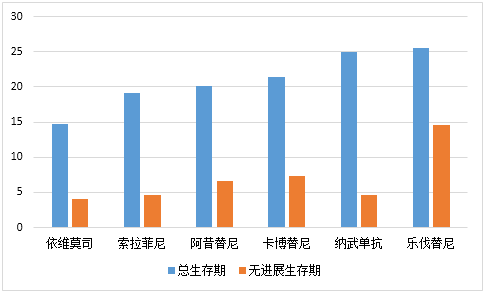
二线治疗近年来快速发展,靶向药物及其联合治疗、免疫治疗蓬勃发展,疗效不断获得提高,二线 PFS 时间从 4 月延长至 14.6 月,主要数据基础如下:
中国医药工业信息中心CPM(中国新药研发监测数据库)显示,一线治疗药物舒尼替尼2007年国内获批上市。目前除了胃肠道间质瘤、胰腺内分泌肿瘤、转移性肾细胞癌三种适应症获批外,还有多达9种适应症处于临床研究中。处于临床三期的有三种适应症:大肠癌、原发性肝细胞癌、肾细胞癌。

数据来源:中国新药研发监测数据库CPM
舒尼替尼核心专利US 7211600和US 6573293将分别于2020年和2021年失效;
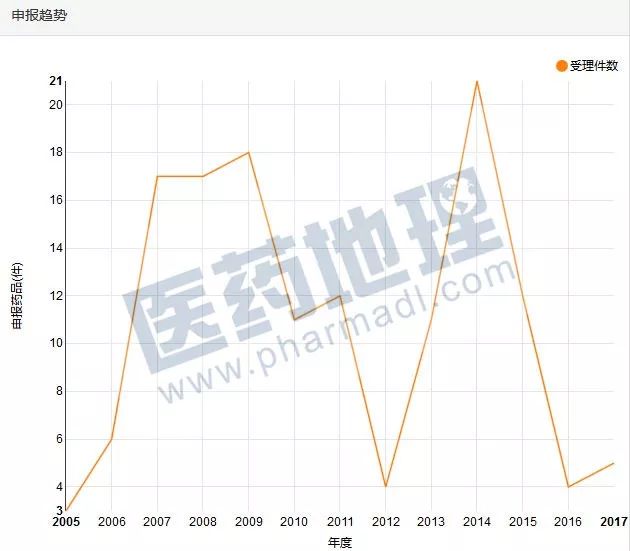
中国新药研发监测数据库CPM申报趋势图显示辉瑞2005年开始申报国内临床试验,2013年前的申报主要是原研厂商辉瑞发起。
数据来源:中国新药研发监测数据库CPM
2013年,齐鲁制药(海南)率先申请舒尼替尼仿制药,经历828天的漫长等待后,于2016年1月14日获批进行生物等效性试验。如果不是赶上CDE解决药品审请积压问题,谁知道还要等多久呢?

数据来源:中国新药研发监测数据库CPM
原研药研发进展
中国新药研发监测数据库CPM显示:舒尼替尼2016年1月26日首先在美上市,同年7月19日获批欧洲上市,2008年日本上市,比中国还要晚。
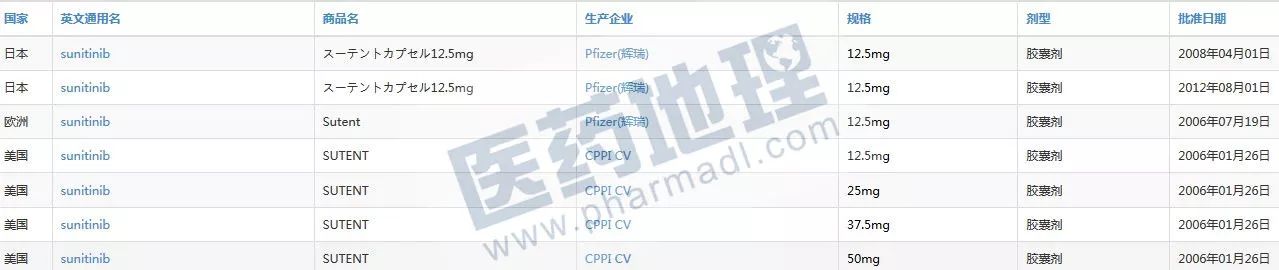
数据来源:中国新药研发监测数据库CPM
中国新药研发监测数据库CPM全球研发情报研发进展事件显示:
2005年8月10日,辉瑞向FDA提交胃肠道间质瘤以及转移性肾细胞癌的上市申请;
2016年1月26日,两大适应症获批,五个月后获批进入欧洲市场;
2007年进入新加坡、马来西亚、中国;
2008年进入日本;
2010年转移性神经内分泌瘤适应症获欧盟批准;
2011年转移性神经内分泌瘤适应症获美国批准;
2016年三期临床结果显示舒尼替尼可显著延长高危肾细胞癌患者肾切除术后的无病生存期。
结语
目前国内上市的肾癌靶向治疗药物均为国外药企原研进口,由于肾癌对放化疗均不敏感,因此靶向治疗成为晚期肾癌的主要治疗手段。本土药企在这里领域的研发热情并不高,也许是因为这并不是一块“大蛋糕”。目前公开资料显示仅有贝达药业的CM082与依维莫司联合用于透明细胞肾癌正在进行三期临床研究,以及君实生物JS001联合阿昔替尼在晚期肾癌Ib期临床研究正在进行。国内关于肾癌的临床试验更是屈指可数。如何通过政策引导创新药研发合理布局,既避免“扎堆盲从”也要避免“无人问津”,鼓励企业积极着眼“未满足的临床需求”,而不是被“市场规模”牵着鼻子走,将是对行业管理者监管智慧的一大考验。
